烯烃知识点归纳(《有机化学基础》烯烃)
一、烯烃的结构和性质
1、烯烃的组成、结构及命名
烯烃是含碳碳双键的烃。
烯烃的官能团是碳碳双键,结构式为。
观察下面几种简单的烯烃(乙烯、丙烯、1-丁烯、1-戊烯)的结构:
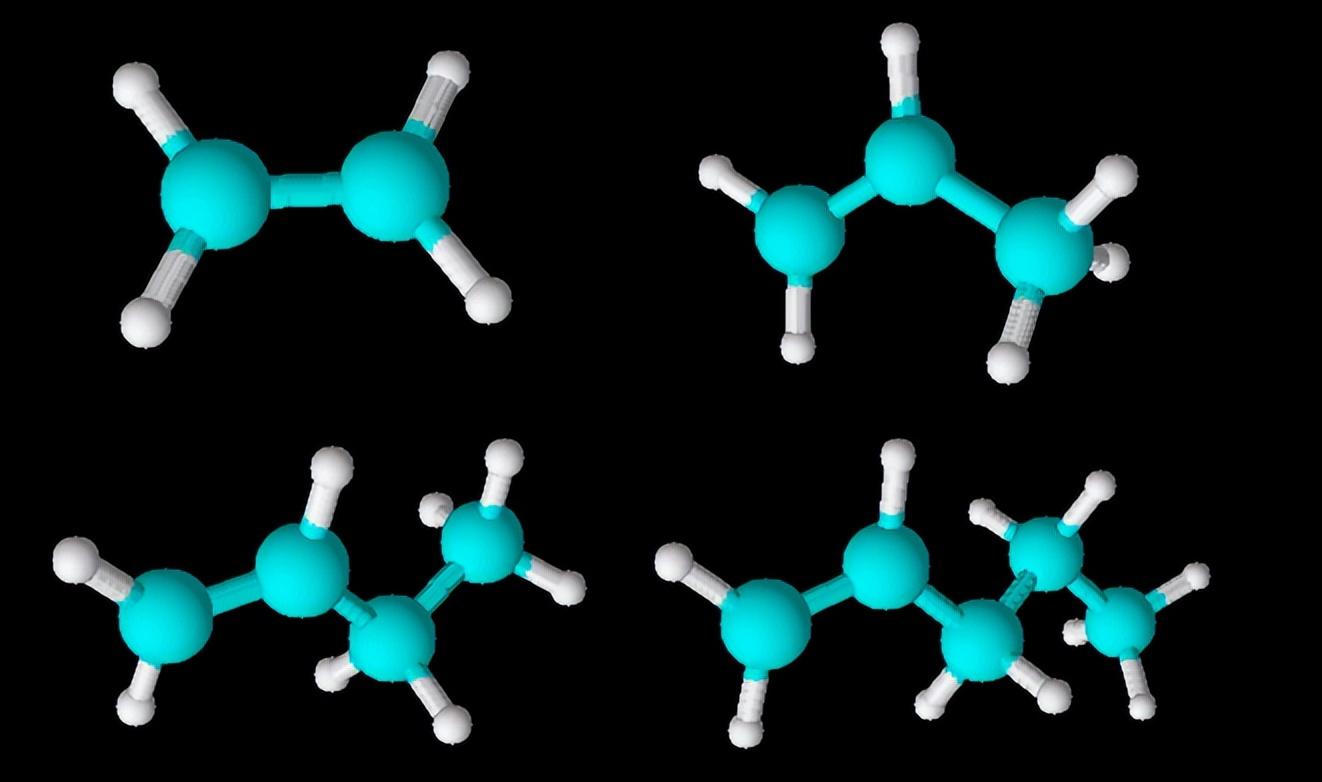
乙烯、丙烯、1-丁烯、1-戊烯的球棍模型
写出其分子式、结构简式:
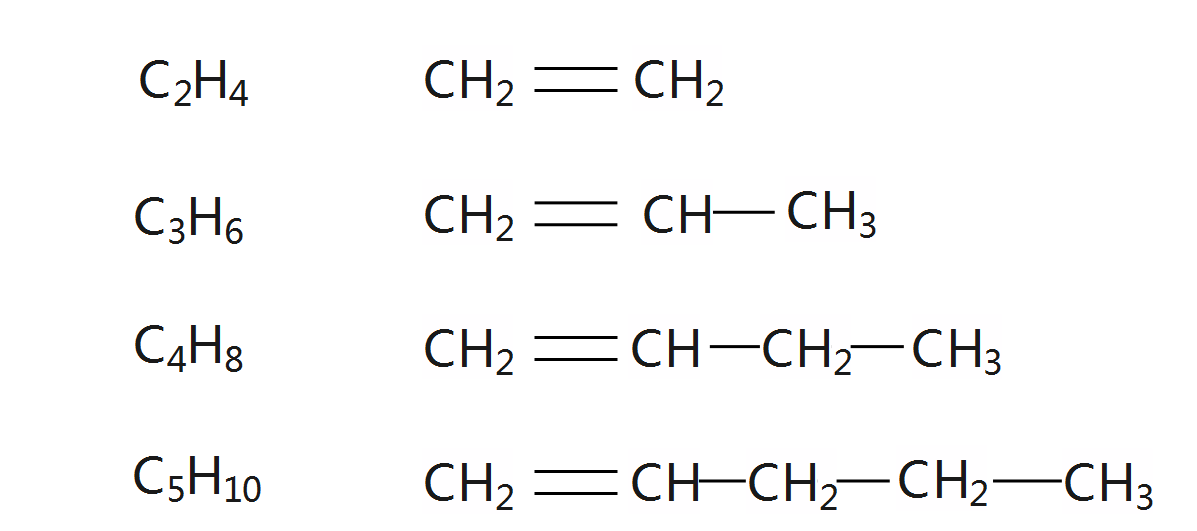
单烯烃(只含有一个碳碳双键的烯烃)比同碳原子的链状烷烃少两个氢原子,所以分子通式为CnH2n(n≥2)。
其中官能团的结构(以乙烯为例):
形成碳碳双键的碳原子均采取
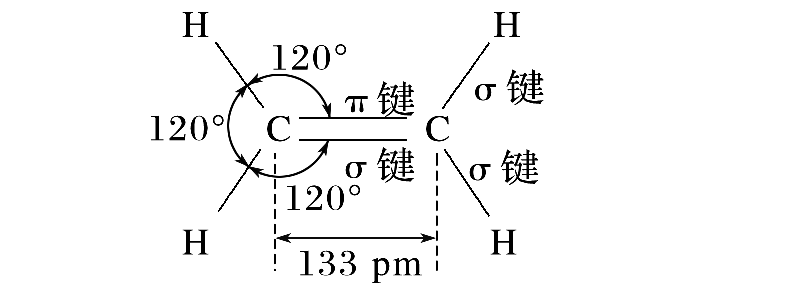
共价键之间的夹角近似120°,而且碳碳双键不能围绕键轴旋转,所以乙烯分子中的6个原子(碳碳双键为中心的6个原子)都在同一平面内。
注意,烯烃中形成碳碳双键的碳原子是

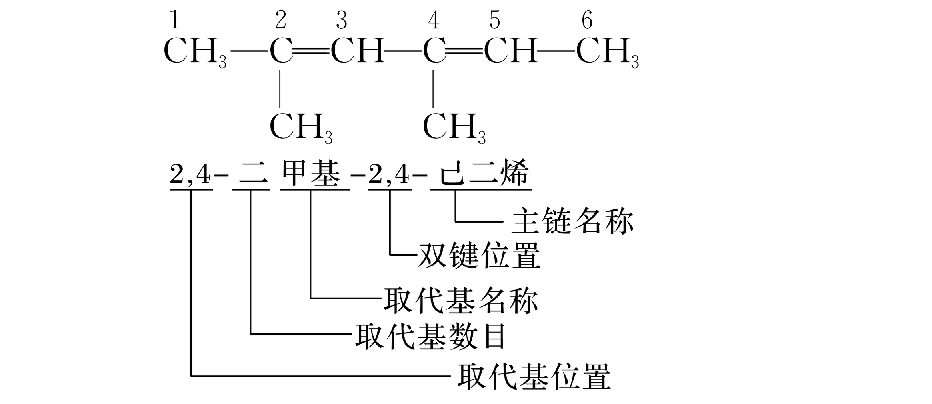
烯烃的命名:
烯烃的命名与烷烃相似,同样遵循“最长、最多、最近、最简、最小”原则,但必须以碳碳双键官能团优先。
第一步,以最长的碳链作主链,但必须含有碳碳双键。依据主链上碳原子的数目,称“某烯”。
第二步,编号时必须从离碳碳双键最近的一端开始。
第三步,写名称时必须用阿拉伯数字标明官能团的位置。
其它的规则与烷烃相同。如:
2、烯烃的物理性质
烯烃的物理性质与乙烯相似,随碳原子数目增加,物理性质又会出现递变规律:
纯净的乙烯为无色、稍有气味的气体,不溶于水,密度比空气略小。
随碳原子数目的增加,烯烃的沸点逐渐升高,状态由气态(碳原子数≤4的烯烃)到液态、固态。
烯烃均难溶于水,密度均比水小。
3、烯烃的化学性质
碳碳双键中的π键易断裂,所以烯烃的化学性质比较活泼,与乙烯相似,容易被氧化,能发生加成反应、加聚反应。但由于它们的结构还有不同的地方,所以化学性质也有不同之处。
(1)氧化反应
碳碳双键可被酸性高锰酸钾溶液氧化,碳碳双键断裂,得到两个酮羰基,生成羧酸、酮或碳酸(会分解成二氧化碳和水,如乙烯)。所以烯烃都能被酸性高锰酸钾溶液氧化,使之褪色。
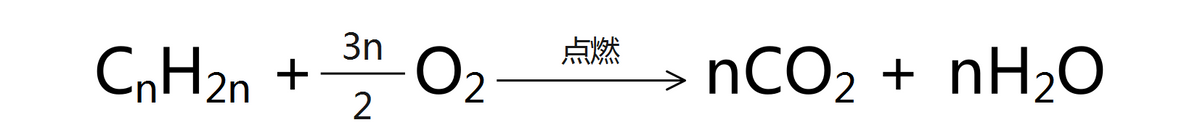
烯烃都有可燃性,完全燃烧生成二氧化碳和水。因烯烃中含碳量高,燃烧时有明亮的火焰,并产生黑烟。
(2)加成反应
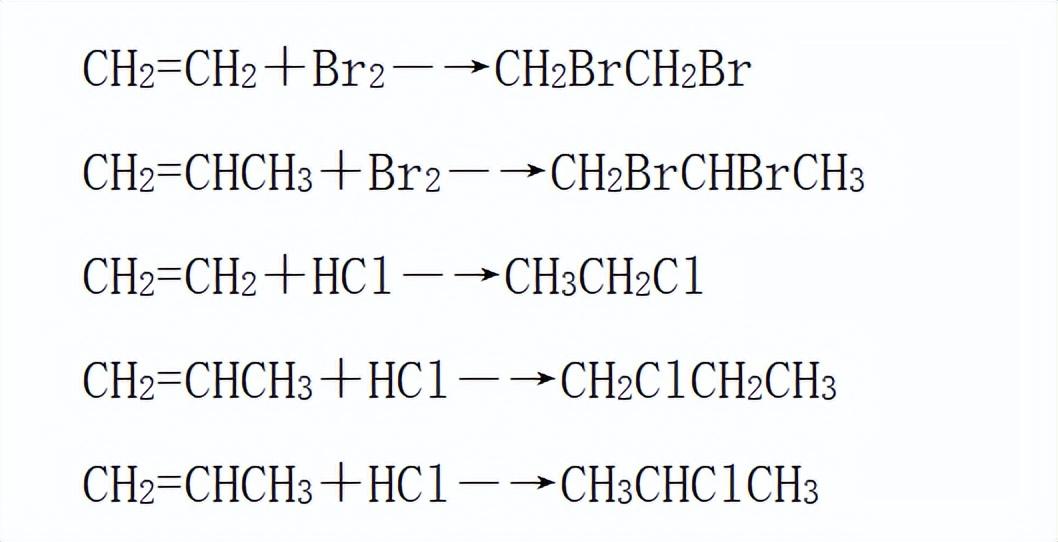
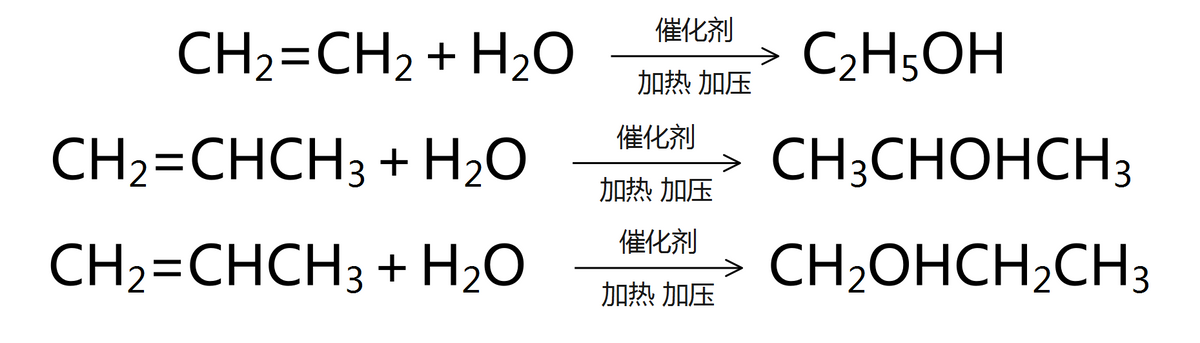
与乙烯相似,烯烃也可与氢气、卤素单质、卤化氢、水等物质发生加成反应。反应机理都是π键断裂,每个碳原子与某原子或原子团形成共价键。
以丙烯为例,对比乙烯、丙烯与溴、氯化氢、水的反应。(注意:丙烯与氯化氢、水的反应都有两种产物)
(3)加聚反应
含有碳碳双键的有机物(不一定是烯烃)在一定条件下能发生加聚反应,得到高分子化合物。
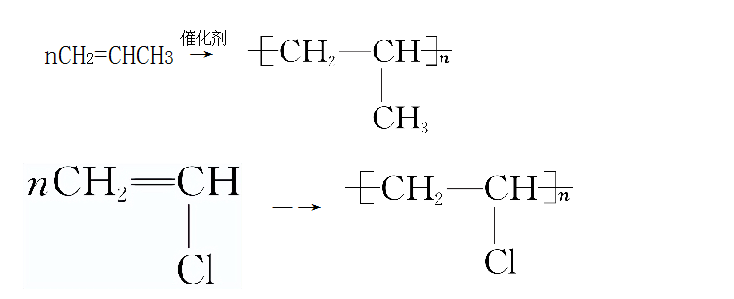
二、烯烃的同分异构体
烯烃的同分异构体有碳架异构、位置异构、官能团异构和顺反异构。
书写烯烃的同分异构体时,一般先写碳架异构,再写碳碳双键的位置异构,最后考虑顺反异构和官能团异构。
如,C4H8的同分异构体,其碳链异构有两种,然后将碳碳双键在不同的碳原子之间移动,得到3种同分异构。
CH2=CH—CH2—CH3
CH3—CH=CH—CH3
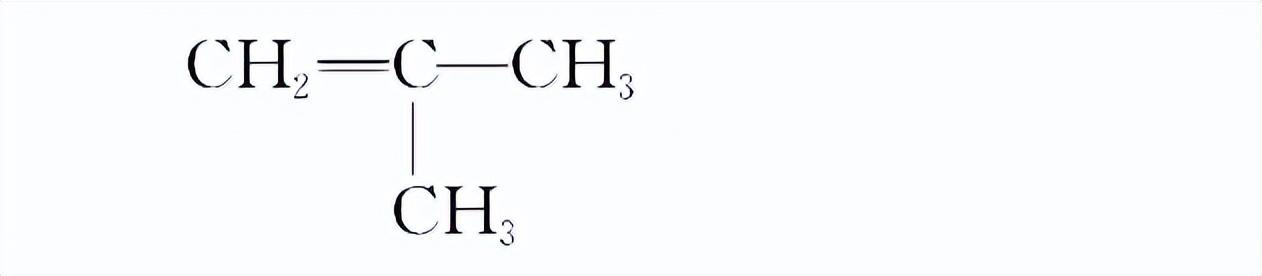
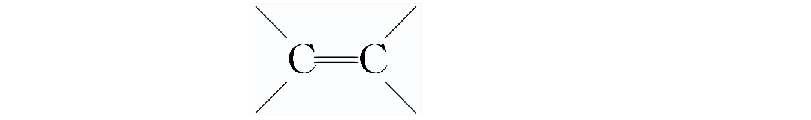
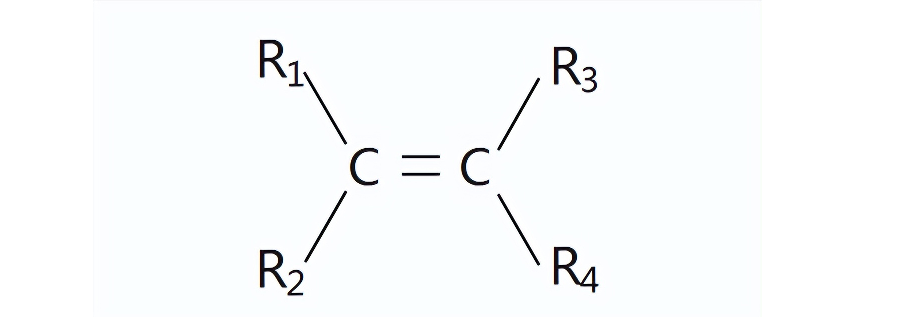
由于碳碳双键不能围绕键轴旋转,所以如果与碳原子相连的基团不一样,则会导致其空间排列方式不同,出现顺反异构。如图,如果R1≠R2,且R3≠R4,则有顺反异构。
把两个相同的原子或原子团位于双键同一侧的称为顺式结构,两个相同的原子或原子团位于双键两侧的称为反式结构。2-丁烯就有两种顺反应异构:顺-2-丁烯和反-2-丁烯。
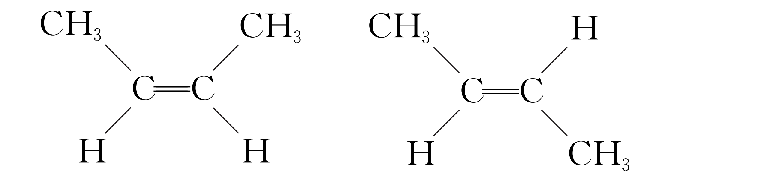
顺反异构体的化学性质基本相同,物理性质有所不同。
单烯烃与环烷烃有同分异构现象。如丙烯与环丙烷(△),丁烯与环丁烷或甲基环丙烷互为同分异构体。
环丁烷和甲基环丙烷









